深入解析:七类溶液的pH值计算

课程预览
大家好,本节课我们将深入探讨溶液的pH计算,涉及七种类型,其难度不容小觑。让我们一起挑战自我,揭开pH计算的神秘面纱。

回顾与基础
在深入学习之前,我们先回顾一下pH与氢离子浓度的关系。pH是氢离子浓度的负对数,公式为:pH = -log[H⁺]。掌握这一基础公式,我们才能更好地进行后续的计算。

类型一:单一溶液pH计算
对于强酸或强碱的单一溶液,例如硫酸和氢氧化钡,我们只需计算出氢离子或氢氧根的浓度,再利用上述公式,即可轻松求出pH值。

类型二:强酸与强碱稀释
对于稀释的强酸或强碱,我们首先要计算稀释后的氢离子或氢氧根浓度,再利用上述公式求出pH。
类型三:弱酸与弱碱稀释
弱酸与弱碱的稀释,只能得到一个大致的pH范围,因为它们在稀释过程中只会部分电离。
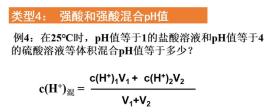
类型四:强酸混合
对于强酸的混合,我们只需将各种酸的氢离子物质的量相加,再除以总体积,即可得到混合后的氢离子浓度,进而求出pH。

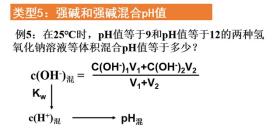
类型五:强碱混合
强碱的混合与强酸类似,只是需要利用水的离子积常数(kw)来求取混合后的氢离子浓度,进而求出pH。

类型六:强酸与强碱混合
当强酸与强碱混合时,我们需要先判断哪种物质过量,然后计算剩余的氢离子或氢氧根浓度,再求出最终的pH。

类型七:弱酸与弱碱混合
对于弱酸与弱碱的混合,我们只能得到一个大致的pH范围,因为它们的混合结果也是部分电离的。
总结与预告
关于溶液pH的计算,我们就先分析这么多。后续还有更多精彩的习题等待着大家一起来研究、探讨。希望大家能够掌握这些计算技巧,并在实践中不断提升自己的能力。
转载请注明来自松文机电,本文标题:《难度非常大的pH计算,共有7种类型 》
百度分享代码,如果开启HTTPS请参考李洋个人博客












 京公网安备11000000000001号
京公网安备11000000000001号